3-3 ダウン症候群の精神状況(3)
ダウン症候群の精神状況(3)
更に続きます。少し専門的になりますがご参考にしてください。
ダウン症候群の精神・神経疾患における病因
脳の状況
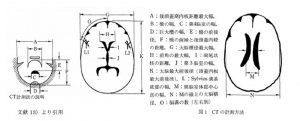
ダウン症(DS)者では頭囲が小さいことが知られています。頭部CT上も以下のような特徴を持っているとされています13)。この論文では26名のDS者(14-47歳)の頭部CTを調べた結果、シルビウス(Sylvius)溝の幅に8例(31%)で開大が見られ、加齢との相関は認められていません。シルビウス溝幅拡大8名のうち6例(75%)でシルビウス(Sylvius)溝比の高値を示し、全員が19歳以上でした。第3脳室比は16例がいずれの年代でも小さい値でした。26例中6例(23%)に巨大槽を、年長者に多く認めています。26例中4例(15%)に透明中隔嚢胞がありましたが40歳代には認めていません。石灰化は26例中22例(85%)であり、その部位は松果体が17例(65%)、大脳基底核が11例(42%)で、10歳代から見られていました。脳内の石灰化は特に早老化現象の指標になるかも知れないとの報告もあります。
その他に、脳幹、小脳、帯状回、前頭葉中間部、上側頭回、海馬が小さく、小脳底部、紡錘状回、側頭葉中部の灰白質の容量の低下を認めます。加齢とともに脳の容量は低下することが知られています。脳における解離した場所からの情報を連結する能力に未熟性を認めるとの報告もあります14)。
メモ:このようにDS者の脳内の状況には様々な特徴がありますが、これと臨床症状がどのように結びついて行くのかは今後の検討を待つことになります。一般の方でも、頭囲の大きさは個人差が大きく、それと知能が必ずしも連動していないことは日頃経験していることではないかと思います。
13)新井幸男ほか. 年長Down症候群26例の頭部単純CT所見について. 脳と発達 27: 17-22, 1995.
14)Anderson JS et al. Abnormal brain synchrony in Down syndrome. Neuro Image Clinl 2: 703-715, 2013.
神経伝達物質
脳内の主な神経伝達物質としては、ノルアドレナリン、ドーパミン、セロトニン、βエンドルフィン、γアミノ酸、グルタミン酸、アセチルコリン、神経ペプチドが挙げられます。
ノルアドレナリンは主な働きとして怒りや不安、恐怖の感情を生むほか、覚醒や記憶とも関係がある。不足するとうつ状態になることが知られています。
ドーパミンは主な働きとして快楽や多幸感を与えるとともに、動機付けや積極的な行動を促し、意欲や運動調節、ホルモン調節などに関わります。
セロトニンは主な働きとして睡眠や体温の調節の他、過剰な興奮や衝動、抑うつ感を軽減し、不足するとうつ状態になることが知られている他、片頭痛の発症にも関係するという説があるモノアミンです。
βエンドルフィンは主な働きとして強い痛みやストレスに対して、多幸感や鎮痛作用をもたらし、ギャバ(GABA)と同じような働きをします。
γアミノ酸はGABAともいわれ、主な働きとして不安を鎮め、心身の緊張を解く抗不安作用、催眠作用やけいれんを鎮めたりする作用があります。
グルタミン酸は主な働きとして興奮性の神経伝達物質で、学習や記憶に大きな役割を果たすアミノ酸です。
アセチルコリンは主な働きとして大脳皮質や海馬などに広く分布し、記憶力や学習意欲などを高めます。
神経ペプチドは主な働きとして鎮静作用、抗うつ・抗不安作用のほか、食欲を高めて摂食を促進させます。
その中でダウン症候群(DS)では、コリンシステム、セロトニンシステム、ノルエピネフリンシステム、ギャバ(GABA)システム、グルタミン酸システムに異常を来すことが知られています15)。
コリンシステムの低下としてDS児の生下時にはコリン作動性ニューロンの神経支配は海馬でも大脳皮質でも正常レベルであるのに、成人ダウン症者は海馬でのコリン終末細胞の劇的な減少を示します。ダウン症マウスでも同様に6ヶ月までは前脳基底核領域コリン作動性ニューロン数は変化がなく、12ヶ月、18ヶ月では正常マウスと明らかに異なっていることを確認できていいます。
セロトニン(5-HT)システムの低下については、DS者においてセロトニンレベルの低下と前シナプスのセロトニン輸送蛋白の減少、および背側縫線核にあるセロトニン細胞のサイズの減少が認められています。セロトニンの障害は、DS者でよく見られる衝動性行動の増加と回避行動の減少をもたらす可能性があります。これらからダウン症者においてセロトニンシステムの障害が示唆され、それに対しての治療戦略が行なわれています。
ノルエピネフリンシステムの低下に関して、DS者では、青斑核の早期で広範囲の変性によって海馬のノルエピネフリンレベルの低下を引き起こされることが知られています。これらとマウスの研究より、海馬におけるノルエピネフリンレベルを上げるか受容体シグナルを改善させればダウン症の認知機能を改善できる可能性を示唆しています。
ギャバ(GABA)システムでは、DS者の海馬の錐体路ニューロンにおけるギャバの異常はこれらのニューロンの長期相乗作用を障害し、学習、記憶の問題を引き起こします。そのため海馬においてのギャバ・シグナルを抑制することはDS者の潜在的治療に役立ちます。DS者の認知機能改善薬として最も良い方法は、ギャバA受容体をブロックすることでギャバシステム介在による過剰抑制を減少させる方法だと思われます。
グルタミン酸システム障害はDS者の神経原線維変化やアミロイド蓄積などのアルツハイマー病様変化と関係します。アミロイドβ(Aβ)蓄積は星状膠細胞内のグルタミン酸の再吸収を抑制し、細胞外のグルタミン酸レベルを上昇させます。結果としてグルタミン酸のN-メチル-D-アスパラギン酸受容体(NMDAR)の結合を増強し、NMDAR活性を高めることで異常興奮や神経損傷を引き起こします。脳の発達と機能に不可欠のセリン・スレオニンキナーゼの1つであるDyrk1A(dual-specificity tyrosine-(Y) phosphorylation regulated kinase 1A)遺伝子は21番染色体に位置しているため、その過剰がダウン症におけるグルタミン酸システムの異常に関連しているとされています。NMDAR遮断薬はダウン症におけるグルタミン酸障害を減少させる方法と考えられます。最近は、非NMDAR遮断薬とは別にAMPAR(αアミノ-3-ヒドロキシ-5-メソオキサゾール-4-プロピオン酸受容体)遮断薬も販売されています。
メモ:ダウン症のモデルマウス:医学の世界では様々な疾患のモデル動物を作成することがあります。先ずは、その疾患のメカニズムを明らかにし、治療法を開発するのに役立っています(こういうと動物愛護の立場からどうかと言う意見が出てきそうです)。ダウン症候群についてもそのネズミ(マウス)を作成しています。マウスの染色体では、人の21番染色体は独立して存在しておらず、16番染色体とくっ付いているものを中心にいくつかの染色体上に散在しています。人でもそうですが、16番が3本ある(トリソミー)と生まれてくることはできません(全部流産してしまいます)。マウスでも同様です。マウスの場合には人の21トリソミーを作ることが自然の状況では不可能です。そのため、マウスの染色体の中に人の21番染色体に位置する様々な遺伝子を分子遺伝学的手法で入れて行く手法でモデルマウスを作成します。かなり、正確なものができています(その専門家が見ると、ダウン症のモデルマウスと言うことがマウスの顔を見て判別が可能だそうです)。このマウスのおかげでヒトの21トリソミーについて様々な研究がされています。最近は、21トリソミーのiPS細胞を用いての研究も進んできています。
15)Das D et al. Neurotransmitter-based strategies for the treatment of cognitive dysfunction in Down syndrome. Prog in Neuro-Psychopharmy & Biol Psychiat 54; 140-148, 2014.
アルツハイマー病
DS者は40歳までにアルツハイマー病(AD)に特徴的な脳における老人斑と神経原線維変化が起こり、加齢と伴に認知症の症状を持つとされます。しかし、より老齢のDS者でも認知症症状を伴わない例も知られており、DS者の中にはADの発症をおさえることができている人もいることを示唆しています。ADの症状においては21番染色体上のコーディング配列(最終的にアミノ酸(タンパク質)を作るのに関係する領域の遺伝子配列)や非コーディング配列の量的異常に起因するが、これらの中でアミロイド前駆体蛋白(APP)がADの病因のキーになっていると考えられています。この仮説と一致して、APPが3コピーある微細な21番染色体重複患者(Dup-APP)も若年性ADになることが知られています。逆にAPP過剰に起因しない21番染色体の部分トリソミーではADにつながらないとされています。その他にいくつかの21番染色体上の付加的遺伝子がAD-DSの経過を修飾していることが示唆されています。Dup-APP患者においてADの発症年齢は39-64歳(平均52歳程度)で、65歳までに症状が明らかになると言われています。その一方、AD-DS者の多くは55歳以上で認知機能の明らかな低下が起こるし、免れる人もいます。そのため、21番染色体上に認知症を防ぐ重要な遺伝子の重複が存在することが示唆されますが詳細は不明です。更にDup-APPの患者では頭蓋内出血がよく見らます(20-50%)が、ダウン症者では一般的に少ないとされます。つまり、21番染色体上のある遺伝子(群)の重複はADの併存疾患を防ぐ可能性もあります。可溶性Aβ42は50%の21トリソミー胎児脳でも認められるとされています。しかし、これはダウン症者で動脈硬化が少なく高血圧の人がほとんどいないことも関係するかも知れません。
APPに影響を与える21番染色体上の遺伝子としては、APPを増加させるETS2やAPP翻訳後に調節の役割を果たすSUMI3, DYRK1Aが知られています。microRNA miR-155はγセクレターゼ活性を調節するとされています。BACE2はDS者の認知症の発症に影響を与える可能性もあるし、USP16やDYRK1Aはニューロンの発達や機能に、RCAN1やDYRK1Aは細胞間シグナルやTauに影響を与えるとされています。
Aβを減少させる目的ではBACEインヒビターやAβ予防接種が効果的かも知れません。他にはDYRK1AインヒビターやROSモジュレーターが治療として可能性があります9)。
9)Wiseman FK et al. A genetic cause of Alzheimer disease: mechanistic insights from Down syndrome. Nat Rev Neurosci 16(9): 564-574, 2015.
ネプリライシン
ネプリライシンはII型膜貫通型ペプチターゼで、体内で広く分布していますが脳では尾状核被殻、脈絡叢、淡蒼球、黒質、嗅結節、海馬歯状回分子層、アンモン角網状分子層に強い発現がみられます。ADの発症に中核的な役割を果たすアミロイドβペプチド(Aβ)の分解に関与するとされています16)。アルツハイマー病(AD)脳におけるネプリライシンレベルの低下がアルツハイマー病の前段階であっても認められるとの報告があります17)18)。脳内に蓄積していくAβを分解除去する目的でネプリライシン遺伝子をモデルマウス脳内に導入する遺伝子治療実験が試みられています19)。興味深いことにAPPのリン酸化を制御する分子として21番染色体上に位置するDYRK1Aが関係し、更にDYRK1Aはネプリライシンの活性低下を誘導することも報告されています20)。
これに関係して21トリソミーと正常核型の一卵性双胎からのiPS細胞を用いて、DYRK1A遺伝子の重要性が報告されています21)。薬理学的またはshRNAによってDYRK1Aを標的にすることで、DSのiPS細胞から異常な神経分化のかなりの修正が生じたとのことです。
16)Saido TC, Iwata N: Metabolism of amyloid beta peptide and pathogenesis of Alzheimer’s disease. Towards presymptomatic diagnosis, prevention and therapy. Nerosci Res 54(4): 235-253, 2006.
17)Wang DS et al. Oxidized neprilysin in aging and Alzheimer’s disease brains. Biochem Biophys Res Commun 310(1): 236-241, 2003.
18)Miners JS et al. Decreased expression and activity of neprilysin in Alzheimer disease are associated with cerebral amyloid angiopathy. J Neuropathol Exp Neurol 65(10): 1012-21, 2006.
19)Iwata N et al. Global brain delivery of neprilysin gene by intravascular administration of AAV vector in mice. Sci Rep 3: 1472, 2013.
20)浅井 将:APPのリン酸化制御―副作用の少ない新しいアルツハイマー病治療薬を目指してー 科学研究費助成事業 研究成果報告書 24790260 平成27年6月8日.
21)Hibaoui Y et al. : Modelling and rescuing neurodevelopmental defect of Down syndrome using induced pluripotent stem cells from monozygotic twins discordant for trisomy 21. EMBO Mol Med 61, 259-277, 2014.
2019年5月12日